A actividade e o exercício físico são essenciais para a manutenção da saúde, mas além disso, na infância são essenciais para potenciar diversos processos físicos, prevenir diferentes patologias que se podem desenvolver na idade adulta –como o excesso de peso e a obesidade- e ajudar a fomentar o bem-estar psicológico. Estes foram alguns dos aspectos em análise durante o Simpósio “Implementação da actividade física, objectivo essencial para a saúde pública”, iniciativa que acaba de ter lugar durante o Congresso Extraordinário da Associação Espanhola de Pediatria (AEP) em Madrid. Os especialistas que participaram no Simpósio destacaram o papel do pediatra e do profissional ligado à actividade física e ao desporto como figuras chave na prescrição de hábitos saudáveis desde a infância, especialmente aqueles relacionados com o fomento da actividade física desde tenra idade.

Para que possa desfrutar das suas férias em segurança deixamos aqui alguns conselhos a seguir.
Na praia
- Opte por praias vigiadas e não mergulhe em locais desconhecidos;
- Utilize boias e braçadeiras adaptadas à idade da criança;
- Respeite as bandeiras e as indicações dos nadadores-salvadores;
- Evite a exposição solar excessiva, usando sempre protetor solar adequado ao seu tipo de pele;
- Os bebés com menos de um ano não devem ser expostos ao sol;
- Ingira líquidos não alcoólicos para evitar a desidratação;
- Consuma alimentos frescos.
Na estrada
- O uso do cinto de segurança é uma medida simples que continua a salvar vidas;
- Se é o condutor, opte por usar calçado fechado, já que os chinelos são perigosos em travagens de emergência;
- O consumo de álcool e o uso do telemóvel são um perigo para quem está ao volante, evite-os;
- Durante o dia, utilize óculos de sol para uma melhor visibilidade;
- E por fim, já sabe: se vai fazer viagens longas, faça paragens regulares para evitar a fadiga.
Tenha um verão em segurança!

Desde há muito, que o mel é utilizado como um alimento com propriedades energéticas e curativas. É composto por frutose, glicose, sacarose e é também rico em Vitamina B, C, D, E e minerais: cálcio, cobre, ferro, magnésio, fósforo, potássio, sódio e zinco e tem ainda um teor considerável de antioxidantes (flavonoides e fenólicos).
Incluir o mel na sua alimentação vai fazer com que sinta algumas melhorias na sua qualidade de vida.
Apesar de também ter um uso externo em que acelera a cicatrização de feridas e queimaduras leves, assim como hidratante da pele, quando ingerido tem as seguintes propriedades:
·é um alimento energético de alta qualidade, por isso é uma fonte energética muito importante para os atletas assim como para os idosos;
·é um alimento melhor do que o açúcar de cana, porque 40% do mel é frutose, o açúcar das frutas, bem menos prejudicial aos diabéticos;
·é um bom condutor em anemia, tratamento de doenças respiratórias e um bom regulador intestinal;
·bom protector do fígado, promovendo a regeneração de suas células e prevenindo a formação do fígado gorduroso (cirrose hepática);
·laxante suave;
·combate as insónias;
·cicatrizante;
·antisséptico;
·ajuda à digestão;
·expectorante.
Como as abelhas recorrem a diferentes tipos de flores para retirarem o néctar, o mel que se consome nem sempre tem o mesmo sabor nem a mesma cor. Porém, existe no mercado mel que não é 100% natural pois contém glicose comercial, calda de açúcar ou melado de cana. Consegue-se facilmente diferenciar quando o mel é natural pois é o único que cristaliza. A cristalização acontece devido a um processo natural em que a glicose se separa da frutose.

Quem garante a qualidade, segurança e eficácia dos medicamentos?
O Infarmed é a entidade responsável em Portugal pela regulação dos medicamentos de uso humano em todo o circuito, desde o fabrico de matérias-primas até à sua dispensa e utilização pelos doentes.
Os medicamentos de uso humano estão sujeitos a elevados padrões de qualidade, segurança e eficácia, tendo por base a articulação conjunta de todos os intervenientes no circuito, tais como fabricantes, distribuidores, médicos, farmácias e utilizadores, assim como das autoridades competentes nacionais e comunitários.
Os diferentes intervenientes no circuito do medicamento estão sujeitos a um conjunto de obrigações e procedimentos competindo ao Infarmed acompanhar e garantir a sua aplicação.
Circuito dos medicamentos de uso humano
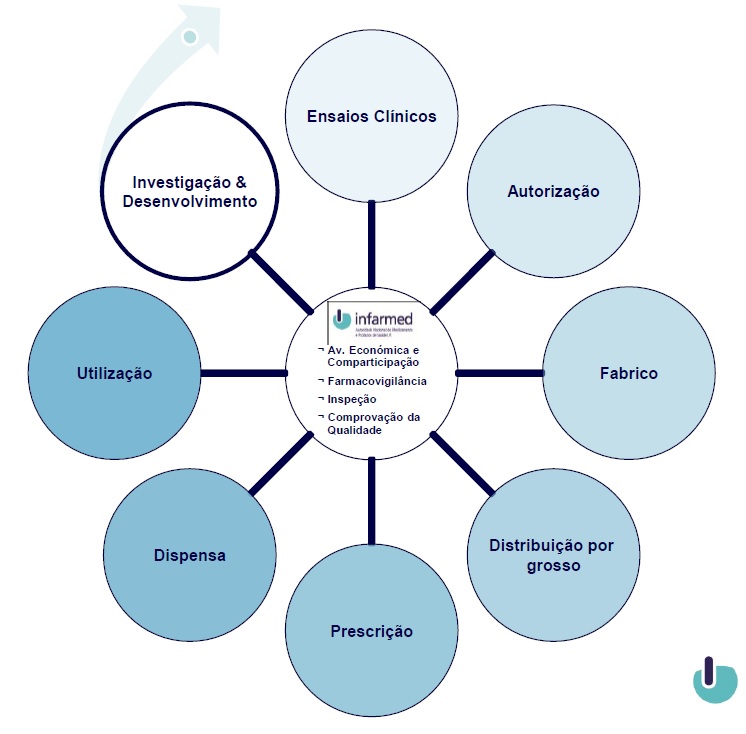
Investigação & Desenvolvimento
Qualquer medicamento começa a ser investigado e desenvolvido cerca de dez anos antes da sua colocação no mercado. Em parceria, a indústria farmacêutica, as faculdades de medicina e de farmácia e outras instituições científicas, nacionais e estrangeiras desenvolvem projectos de investigação, com o objectivo de chegar a uma resposta no combate a determinadas doenças, verificadas na população.
Ensaios clínicos
Antes de ser concedida a Autorização de Introdução do Mercado (AIM) a um medicamento, é ainda necessário testar a eficácia e a segurança da sua utilização no ser humano e para isso realizam-se ensaios clínicos.
Após testes em modelos animais, os medicamentos que obtiverem resultados favoráveis são utilizados experimentalmente em cidadãos voluntários (saudáveis e doentes) para que se obtenha a prova científica de que são seguros e eficazes e como tal podem ser utilizados.
Essa prova científica será analisada para se determinar a relação benefício/risco do futuro medicamento e ajudará também a determinar, com outros factores, se o mesmo pode obter a Autorização de Introdução no Mercado (AIM).
Autorização
Para que um medicamento seja colocado no mercado, é necessário que o Infarmed, ou qualquer agência do medicamento de outro Estado Membro da União Europeia ou a Agência Europeia do Medicamento (EMA) conceda uma Autorização de Introdução no Mercado (AIM).
De modo a garantir a qualidade, a segurança e a eficácia dos medicamentos, a sua aprovação rege-se pelas normas e procedimentos que compõem o Sistema Europeu de Regulação desta área, do qual Portugal faz parte.
Este é um processo rigoroso obedecendo aos mais elevados padrões de qualidade, de modo a garantir a protecção da saúde pública.
À autorização segue-se o seu fabrico ou importação.
Avaliação económica e comparticipação
A avaliação económica tem como objetivo fundamentar a decisão relativamente à comparticipação do Estado no preço dos medicamentos, através da sua avaliação nas vertentes fármaco-terapêutica e económica. Esta avaliação consiste na determinação da mais-valia do medicamento relativamente ao seu valor terapêutico e à sua vantagem económica para o doente.
Fabrico
No âmbito do processo de fabrico, a entidade coordenadora do licenciamento industrial é o Ministério da Economia e do Emprego participando o Infarmed, neste processo, como entidade consultada na área do fabrico de medicamentos e produtos de saúde.
O Infarmed realiza actividades de supervisão e fiscalização, verificando a implementação dos sistemas de boas práticas de acordo com as normas nacionais e procedimentos internacionais estabelecidos pela Comissão Europeia e pela Agência Europeia do Medicamento.
Distribuição
As atividades de abastecimento, posse, armazenagem ou fornecimento de medicamentos destinados à transformação, revenda ou utilização em serviços médicos, unidades de saúde e farmácias, excluindo o fornecimento ao público, depende sempre de autorização do Infarmed.
Prescrição e Dispensa
Os medicamentos são receitados pelo médico, preferencialmente, por via electrónica.
No que respeita à sua venda, os medicamentos podem classificar-se, como:
¬ Sujeitos a receita médica;
¬ Medicamentos de receita médica especial (ex. estupefacientes e psicotrópicos);
¬ Medicamentos de receita médica restrita (uso exclusivo hospitalar ou em alguns casos ambulatório, mas sujeito a uma vigilância especial por parte do especialista durante o período de tratamento);
¬ Não sujeitos a receita médica.
Utilização
Os doentes têm o dever de procurar informação e o direito a ser informados quanto às suas próprias responsabilidades para um uso correto e adequado dos medicamentos. Os profissionais de saúde, médicos e farmacêuticos, que têm um papel fundamental na promoção da utilização racional dos medicamentos, deverão prestar todos os esclarecimentos aos doentes, sempre que necessário.
Farmacovigilância
Sempre que o doente suspeitar de uma reacção adversa provocada pela utilização de um medicamento, deve de imediato informar o profissional de saúde que o assiste.
Os profissionais de saúde (médicos, farmacêuticos e enfermeiros) comunicam ao Infarmed, tão rápido quanto possível, as reacções adversas e suspeitas de reacções adversas graves ou inesperadas de que tenham conhecimento resultantes da utilização de medicamentos.
O Infarmed analisa e avalia estas reacções e consoante a sua gravidade e repercussão, pode tomar medidas que podem passar pela emissão de alertas, pela suspensão parcial ou retirada do mercado de determinado medicamento.
Inspecção
As acções de inspecção, da responsabilidade do Infarmed, visam averiguar, identificar e monitorizar defeitos de qualidade relativos à produção industrial de medicamentos e à actividade de licenciamento de entidades, nomeadamente, armazenistas, farmácias e locais de venda de medicamentos não sujeitos a receita médica.
Estas acções incidem sobre a:
¬ Produção de medicamentos;
¬ Avaliação do cumprimento das boas práticas de fabrico;
¬ Monitorização dos medicamentos comercializados.
Caso se detectem não conformidades o Infarmed solicita a sua correcção num determinado prazo.
Se as mesmas forem consideradas críticas e previstas na legislação poderá haver lugar à instrução de processo de contraordenação social.
Comprovação da qualidade
O Infarmed, através do seu laboratório, tem também como missão verificar a qualidade dos medicamentos, bem como das matérias-primas e dos produtos de saúde (dispositivos médicos, cosméticos, etc.) que se comercializam em Portugal.
Os lotes de medicamentos que não cumprem as especificações são alvo de medidas adequadas a cada caso específico, destinadas a garantir que os medicamentos que os doentes têm à sua disposição, têm qualidade, são seguros e eficazes.
Contactos e Informações adicionais
Através deste conjunto de actividades, o Infarmed e as restantes entidades envolvidas, garantem a qualidade, a segurança e a eficácia de todos os medicamentos à disposição dos doentes em Portugal.
Para informações mais detalhadas sobre o ciclo de vida do medicamento, consulte as áreas técnicas do site do Infarmed ou marque a Linha do Medicamento, 800 222 444, para esclarecimentos adicionais.
São mais 100 lugares do que estava inicialmente previsto pelo Ministério da Saúde.
Em comunicado, os responsáveis da Administração Regional dizem que o objectivo é atribuir médico a mais 285 mil utentes da região de Lisboa.
Estas 150 vagas vão ser distribuídas por vários agrupamentos de centros de saúde e só no concelho de Sintra, um dos maiores do país, serão colocados mais 22 médicos de família.
No anúncio, a empresa explica ter decidido retirar do mercado os casacos de bebé a partir dos três meses e até aos dois anos, porque os botões daqueles artigos correm o risco de se soltar.
“Ao puxar um fio saliente de um dos botões, o botão poderá cair. Se os bebés levarem à boca o botão solto e o engolirem, isto poderá representar um risco de asfixia”, explica a empresa, salientando que, apesar de não ter sido registado qualquer incidente, os casacos vão ser retirados do mercado por precaução.
No comunicado, a C&A pede aos consumidores que devolvam os casacos de bebé de cores vermelho e cor-de-rosa (com os números da referência 321/02/02/74522/803 e 321/02/74522/805), com os tamanhos 68 a 92 (a partir dos 3 meses a 2 anos). “Pode devolver os casacos de bebé em qualquer loja C&A ou enviá-los por correio, sem qualquer custo. Iremos reembolsar a totalidade do valor”, referiu a empresa.
A C&A sublinhou que não foram registados até ao momento quaisquer danos pessoais, tratando-se apenas de uma medida preventiva voluntária.
“Dois pontos fulcrais também em discussão nesta reunião foram as dificuldades verificadas na dotação de pessoal, designadamente médico, e as complicações decorrentes da publicação da portaria 82/2014, que classifica os serviços e instituições do Serviço Nacional de Saúde, e que poderá esvaziar a capacidade de resposta às populações do Consultivo do Centro Hospitalar de Leiria (CHL) em algumas valências”, informou o hospital.
O Conselho de Administração do CHL apresentou o Plano Estratégico para o triénio 2013-2015, onde se destacam os “objectivos estratégicos relativos à reforma hospitalar, sustentabilidade económico-financeira, articulação com as redes de cuidados primários e cuidados continuados, adequação de cuidados às necessidades das populações e à gestão clínica”.
Segundo eles, este ligamento tem um papel fundamental na recuperação dos pacientes com ruturas do ligamento cruzado anterior, que é uma lesão comum entre os atletas. Os médicos dizem que esta descoberta pode revolucionar o tratamento e a recuperação das rupturas de ligamentos.
Para os desportistas profissionais, uma ruptura no ligamento cruzado anterior pode implicar o fim da carreira. Mesmo depois de cirurgia e longas reabilitações, não há garantias de recuperação. Mas o especialista Johan Bellemans acreditou sempre que era possível fazer melhor.
“Quando alguém rompe o ligamento cruzado anterior e é sujeito a cirurgia, sabemos que 10 a 20% dos pacientes continuarão a ter uma qualquer deficiência. Isso não faz sentido, porque reparámos a lesão. E portanto achámos que tinha de haver outra estrutura lesionada e que continuava por reparar”, explica o professor universitário John Bellemans.
Agora, Bellemans e o colega Steven Claes, da Universidade de Lovaina, dizem ter identificado essa estrutura, examinando em detalhe os joelhos de mais de quarenta dadores.
É uma faixa fibrosa até agora desconhecida, que fica entre os quatro ligamentos que ligam o fémur e a tíbia. Chamaram-lhe ligamento ântero-lateral, e afirmam que entender o seu funcionamento pode alterar radicalmente o tratamento das lesões nos ligamentos do joelho. Enquanto o ligamento cruzado anterior fica dentro do joelho, o ligamento ântero-lateral fica do lado de fora.
Enquanto o ligamento cruzado anterior controla a estabilidade da frente para trás, este ligamento controla a rotação do joelho. O que nós descobrimos foi que em várias lesões do ligamento cruzado anterior ambos os ligamentos pareciam afectados. É de esperar alguma falta de firmeza e instabilidade, sobretudo na rotação, se só operarmos uma das lesões.
Os atletas sofrem lesões nos ligamentos do joelho quando mudam de direcção ou travam bruscamente. Há rupturas ligeiras, outras mais graves, e alguns rompimentos podem mesmo trazer consequências duradouras. Claes acredita que este ligamento recém-descoberto pode ter um papel importante na prevenção de rotações abusivas do joelho. Todavia, alguns especialistas como Marc Martens, cirurgião de renome do mundo do futebol, acreditam que a descoberta não deixa de ser interessante, mas que a sua importância está a ser largamente exagerada.
“Há mais do que o ligamento ântero-lateral, há mais do que esta faixa fibrosa. É preciso saber que há mais que isso. Todas estas estruturas laterais - incluindo o ligamento ântero-lateral - estão lesionadas e distendidas”, refere Marc Martens, Cirurgião acreditado pela FIFA.
Claes e Bellemans publicaram a sua investigação no “Journal Of Anatomy”. Dizem que, apesar das técnicas cirúrgicas mais avançadas, quase metade dos atletas não consegue voltar a ter o mesmo desempenho que tinha antes da lesão.
Eles estão convencidos de que o ligamento ântero-lateral é a chave para melhorar as recuperações e prolongar as carreiras de atletas em todo o mundo.
Subsídio de educação especial deve ser revisto
A proposta integra as conclusões do grupo de trabalho que, ao longo dos últimos meses, teve a cargo um estudo para a revisão da legislação relativa à educação especial, e que ontem apresentou resultados numa sessão no Palácio das Laranjeiras, em Lisboa, que contou com a presença dos secretários de Estado do Ensino Básico e Secundário, João Grancho, do Ensino e da Administração Escolar, Casanova de Almeida, e da Solidariedade e da Segurança Social, Agostinho Branquinho.
As conclusões do grupo de trabalho apontam para a necessidade de alguma revisão da legislação, sobretudo ao nível da integração num único diploma dos diversos normativos dispersos, que deve, acima de tudo, clarificar conceitos, sobretudo no que diz respeito à separação entre necessidades educativas especiais permanentes ou temporárias ou, dito de outra forma, entre o que realmente se enquadra na educação especial e o que deve apenas ser classificado como dificuldades de aprendizagem.
“Essa distinção, à partida, da população alvo da educação especial é determinante. É necessário especificar e clarificar que públicos é que são alvos da educação especial”, afirmou João Grancho, que sublinhou que as necessidades educativas especiais se transformaram numa “grande categoria” onde cabe tudo, afirmando que é preciso rever o que considerou uma “fragilidade ao nível dos conceitos”.
“Mesmo que venhamos a introduzir alguma diferenciação a este nível, as escolas deverão continuar a prestar os apoios aos alunos que precisarem”, frisou o secretário de Estado.
A propósito da recomendação recente do Conselho Nacional de Educação sobre a educação especial, que apontava para falhas na prestação dos apoios a estes alunos e para desigualdades territoriais no acesso, João Grancho disse que “esse desatendimento incorre numa lógica de integrar na educação especial todo o tipo de alunos com dificuldades”, o que leva a que “os recursos sejam desviados das necessidades de carácter permanente”.
João Grancho declarou que “os recursos necessários” têm de ser afectados “à medida das necessidades que forem detectadas”.
“Não há qualquer restrição ao investimento ou orientação no sentido de diminuir o investimento que tem vindo a ser feito”, garantiu, sublinhando o crescimento que houve a este nível nos últimos dois anos lectivos, e recusando a ideia de que esta seja “uma área descuidada pelo Governo”.
“Temos vindo a incrementar os apoios disponibilizados e os recursos, de uma forma que é resultante da pressão que vai surgindo, deste crescimento quase descontrolado com necessidades educativas especiais, quando todos nós sabemos que um aluno que integre este quadro das necessidades educativas especiais dificilmente é retirado, e quando muitas vezes estamos a falar de dificuldades de aprendizagem”, afirmou o secretário de Estado.
De acordo com a proposta do grupo de trabalho, um novo quadro normativo deverá manter o âmbito de intervenção dos serviços de educação especial, centrado no que está previsto no decreto-lei de 2008, que enquadra os apoios a estes alunos e que estabelece que os apoios especializados devem ser prestados a crianças “com alterações de carácter permanente nas estruturas e funções do corpo”.
De acordo com uma actualização do Instituto Português do Mar e da Atmosfera (IPMA) às 07:00, além de Setúbal, Évora e Beja, vão estar também sob aviso amarelo (entre as 10:00 de hoje e as 23:59 de sábado) os distritos de Lisboa e Leiria devido à persistência de valores elevados da temperatura máxima.
Os distritos de Setúbal, Évora e Beja vão estar sob aviso amarelo, o segundo menos grave de uma escala de quatro, entre as 10:00 de hoje e as 06:00 de sábado.
As temperaturas máximas vão subir gradualmente, entre dois a sete graus, até domingo, devido a uma “corrente de leste que vai instalar-se no continente”, segundo o IPMA.
De acordo com o IPMA, a subida da temperatura deve-se a uma corrente de leste que vai instalar-se no continente desde os Açores até à Europa central, dando origem a temperaturas elevadas perfeitamente normais para esta altura do ano.
A tendência a partir da próxima segunda-feira é para uma ligeira descida da temperatura.
Em Lisboa e Castelo Branco prevê-se uma temperatura máxima de 34 graus Celsius, em Évora 36, em Beja 35, em Braga e Coimbra 33, Bragança, Vila Real e Portalegre 32, no Porto 28, Leiria e Viseu 31, Faro 30, Funchal 25, Ponta Delgada e Angra do Heroísmo 23 e Santa Cruz das Flores 22.
O jornal Público adianta hoje que a indústria farmacêutica concedeu apoios e subsídios no valor de mais de 28,6 milhões de euros a profissionais e organizações do setor da saúde, entre Janeiro e Junho deste ano, mas que estes profissionais comunicaram que neste período receberam apenas 8,4 milhões de euros dos laboratórios.
Os dados usados pelo Público estão disponibilizados na plataforma informática da Autoridade Nacional do Medicamento (Infarmed), criada para divulgar apoios da indústria farmacêutica a profissionais e organizações do setor, associações de doentes e sociedades médicas incluídas.
Em declarações, o presidente da Federação Nacional dos Médicos (FNAM) disse estar surpreendido e surpreso com os dados divulgados mais de um ano depois da entrada em vigor da lei que obriga os médicos a notificar o Infarmed de que receberam apoios concedidos pelos laboratórios farmacêuticos superiores a 25 euros.
“Surpreende-nos estes comentários, nesta altura. Se de facto atingiu estas proporções, teriam que estar já referenciadas há algum tempo. Se isto acontece é porque as administrações não fazem o que deviam fazer”, salientou.
Para Sérgio Esperança, as “leis são feitas para cumprir e se há quem não as cumpra é porque não há quem vigie o seu cumprimento”.
“Estes números são enormes. Quando um médico sai numa comissão de serviço tem de registar os patrocínios que são atribuídos. Se isso não é feito, não é vigiado, os faltosos não têm desculpa, mas as administrações têm um papel relevante nisto e não o exercem”, concluiu.
Por seu turno, o bastonário da Ordem dos Médicos, José Manuel Silva, defendeu hoje, em declarações, que o Ministério da Saúde, “em vez de criticar”, deveria substituir a indústria farmacêutica e apoiar a formação e a investigação científica dos clínicos.
“No sentido de estimular a transparência e aumentar a separação entre clínica e indústria farmacêutica, o ministério deve substituir a indústria no apoio à formação contínua dos médicos, porque se não o fizer, corremos o risco de serem afectadas. Infelizmente, o ministério não assume as suas obrigações e é, por isso, que o apoio da indústria farmacêutica é insubstituível”, argumentou José Manuel Silva.
O Bastonário da Ordem dos Médicos vai publicar em breve um parecer do seu departamento jurídico que esclarece que os médicos têm que comunicar donativos.
Contactado sobre este assunto, o Ministério da Saúde referiu que os dados referidos são públicos, resultam da lei, e remeteu mais comentários para o Infarmed, de quem ainda não foi possível obter uma resposta.
Ao jornal Público, o Infarmed, responsável pela plataforma informática e a sua monitorização, garantiu que tem vindo a “monitorizar esta ferramenta, prosseguindo com as alterações necessárias com vista à melhoria do seu funcionamento”.
Para a Associação Nacional de Estudantes de Medicina (ANEM), a reclassificação dos hospitais não pode ser pensada sem ter em conta “o importante papel das unidades hospitalares portuguesas enquanto instituições com responsabilidade pelo ensino da medicina”.
Segundo um comunicado hoje divulgado, a associação espera que a nova categorização dos hospitais não conduza a um decréscimo de vagas para a formação pré e pós-graduada em medicina.
Os estudantes de medicina apelam a uma reavaliação da portaria publicada em Abril, que hierarquiza os hospitais, prevendo a retirada de serviços ou valências a algumas unidades.
“A portaria preconiza a perda de valências de várias unidades hospitalares, o que poderá afectar o ensino pré-graduado prestado pelas unidades hospitalares afiliadas a escolas médicas, assim como reduzir a capacidade formativa do internato médico”, refere a Associação Nacional.
A ANEM lembra que, actualmente, a formação médica está dependente de protocolos entre escolas médicas e unidades hospitalares, que permitem que “centenas de estudantes tenham uma formação clínica necessária e adequada em diversas especialidades médicas”.
Quanto ao internato médico, também cumprido nos hospitais, é o que permite aos estudantes tornarem-se médicos “autónomos e especialistas, garantindo a qualidade da prestação de cuidados de saúde em Portugal”.
A portaria que reclassifica os hospitais tem motivado várias acções de protesto, nomeadamente organizadas por sindicatos e utentes, que reclamam a revogação do diploma que retira valências a algumas unidades de saúde públicas.
Este prémio tem o valor de cerca de 255 mil euros e vai permitir que durante três anos a equipa de Henrique Veiga-Fernandes possa analisar a forma como as células inatas linfoides são controladas e assim procurar determinar a causas e novas terapias para doença de Crohn.
De um total de 69 projectos submetidos, a Crohn's & Colitis Foundation of America’s (CCFA) atribuiu oito prémios, sete a investigadores norte-americanos e um ao projecto liderado pelo investigador do Instituto de Medicina Molecular (IMM), constituindo o primeiro prémio na história da Fundação americana atribuído a uma equipa portuguesa.
Para Henrique Veiga-Fernandes este prémio “vai permitir elucidar novos aspectos da doença inflamatória do intestino. A esse respeito, os nossos resultados iniciais são muito promissores pois revelam a existência de uma nova molécula, até agora desconhecida, que controla as respostas inflamatórias intestinais. Esta descoberta abre agora portas para novas linhas de investigação inovadoras na terapêutica e diagnóstico da doença de Crohn.”
A Doença de Crohn carateriza-se por uma inflamação crónica que pode afectar qualquer segmento do tubo digestivo na qual os sintomas mais comuns são a diarreia, a dor abdominal e a perda de peso. Trata-se de uma doença crónica, multifatorial e ainda mal compreendida, que pode evoluir por surtos e para a qual ainda não há cura.
Em Portugal, estima-se que a prevalência seja de 73 por cada 100 000 habitantes, atingindo maioritariamente mulheres, apresentando um pico de incidência entre 17 anos e 39 anos.
Células inatas linfoides são uma classe de células do sistema imunológico descobertas muito recentemente. Estudos anteriores liderados pela equipa de Henrique Veiga-Fernandes (Nature, 2007; Nature, 2014), entre outros, têm relacionado estas células com a regulação de respostas imunes no intestino, principalmente através da sua capacidade de pro-inflamatória, na formação de tecido linfoide e na regeneração e homeostasia dos tecidos.
A equipa de Henrique Veiga-Fernandes pretende agora esclarecer como é que factores que regulam o sistema nervoso podem controlar a função inflamatória das células inatas linfoides e garantir a preservação de um intestino saudável.
Num artigo publicado na revista científica Proceedings of the National Academy of Sciences (PNAS), os investigadores avançam que os resultados do estudo explicam como o sono em insuficiência prejudica a saúde.
Os investigadores nomeiam doenças cardíacas, diabetes, obesidade e mau funcionamento do cérebro como possíveis causa do pouco descanso. O processo pelo qual o défice de sono altera o estado de saúde não é, no entanto, descrito pelos cientistas.
A equipa da Universidade de Surrey, no Reino Unido, recolhei amostras de sangue de 26 pessoas depois de estas terem dormido até dez horas por noite durante uma semana.
Na segunda fase dos testes, o mesmo grupo foi submetido a uma semana de sono insuficiente - menos de seis horas por noite. Logo depois, foram recolhidas novas mostras de sangue.
Ao comparar as amostras, os cientistas observaram que a actividade de 700 genes no organismo dos participantes alterou-se após a mudança no padrão de sono.
Cada gene contém instruções para a fabricação de uma proteína. Portanto, os que ficaram mais activos produziram mais proteínas e isso alterou completamente a configuração química no corpo dos voluntários.
O relógio natural dos organismos também ficou perturbado pela falta de sono. A actividade de alguns genes aumenta e diminui no decorrer do dia, mas esse efeito foi enfraquecido pelo défice de sono.
Colin Smith, da Universidade de Surrey, disse que “houve uma mudança dramática na actividade de muitos tipos diferentes de genes”, descreve a BBC.
“Áreas como o sistema imunitário e a forma como o organismo reage aos danos e ao stress foram afectadas”, acrescentou.
“Claramente, dormir é essencial para a reconstrução do corpo e a manutenção de um estado funcional. Caso contrário, vários tipos de danos parecem acontecer, o que pode resultar em doenças. Se não podemos reabastecer ou substituir as células, isso leva à formação de doenças degenerativas”, alerta.
O especialista lamenta ainda que muitas pessoas podem conviver com défices de sono ainda maiores do que os estudados.
José Manuel Silva reagia assim, em declarações, à notícia divulgada hoje no jornal Público, segundo a qual a indústria farmacêutica declarou apoios e subsídios muito superiores aos efectuados pelos profissionais de saúde, explicando tratarem-se de donativos para formação e investigação dos médicos pela indústria farmacêutica.
“No sentido de estimular a transparência e aumentar a separação entre clínica e indústria farmacêutica, o ministério deve substituir a indústria no apoio à formação contínua dos médicos, porque se não o fizer, corremos o risco de serem afectadas. Infelizmente, o ministério não assume as suas obrigações e é, por isso, que o apoio da indústria farmacêutica é insubstituível”, argumentou.
O jornal Público adianta hoje que a indústria farmacêutica concedeu apoios e subsídios no valor de mais de 28,6 milhões de euros a profissionais e organizações do sector da saúde, entre Janeiro e Junho deste anos, mas que estes profissionais comunicaram que neste período receberam apenas 8,4 milhões de euros dos laboratórios.
Os dados usados pelo Público estão disponibilizados na plataforma informática da Autoridade Nacional do Medicamento (Infarmed), criada para divulgar apoios da indústria farmacêutica a profissionais e organizações do sector, associações de doentes e sociedades médicas incluídas.
Em declarações, o bastonário da Ordem dos Médicos disse que, por lei, desde Fevereiro de 2013, os médicos têm de notificar o Infarmed de que receberam apoios concedidos pelos laboratórios farmacêuticos superiores a 25 euros.
“Os apoios não são só a médicos. Há apoios a instituições, sociedades científicas, associações de doentes, enfermeiros. Não sei qual é a discrepância entre o apoio recebido e o declarado pelos clínicos ao Infarmed”, disse, acrescentando que a Ordem vai divulgar em breve um parecer jurídico que esclarece que os médicos têm que comunicar donativos.
José Manuel Silva sublinhou que a Ordem defende “acima de tudo a transparência”, mas considerou ser um absurdo da lei que os médicos tenham de reportar apoios à investigação e a congressos, quando a indústria já o faz.
“Não faz sentido os médicos também o fazerem, está lá tudo, mas obriga à duplicação de procedimentos sem necessidade. A indústria já faz essa notificação ao Infarmed. É obrigar os médicos a ter mais trabalho, mas enfim, cumpre-se, não há aqui nenhuma fuga à transparência. Está lá tudo”, salientou.
Contactado, o Ministério da Saúde referiu que os dados referidos são públicos, resultam da lei, e remeteu mais comentários para o Infarmed, cujo contacto ainda não foi possível.
Ao jornal Público, o Infarmed, responsável pela plataforma informática e a sua monitorização, garantiu que tem vindo a “monitorizar esta ferramenta, prosseguindo com as alterações necessárias com vista à melhoria do seu funcionamento”.
“As pessoas mais expostas ao risco são os próprios trabalhadores, que uma vez terminada a greve vão ter de manipular o lixo e recomenda-se que tenham cuidado”, disse o presidente da Associação Nacional dos Médicos de Saúde Pública (ANMSP), Mário Jorge Santos.
A paralisação de quinta-feira, dia dos Casamentos do Santo António e das Marchas Populares e na véspera do dia da cidade, foi convocada pelo Sindicato dos Trabalhadores do Município de Lisboa (STML) e pelo Sindicato dos Trabalhadores da Administração Local (STAL), abrangendo todos os sectores e funcionários da autarquia e das juntas de freguesia de Lisboa.
Os trabalhadores do município também vão estar em greve ao trabalho extraordinário entre 13 e 22 Junho, e no dia 14 de Junho os trabalhadores da limpeza urbana vão parar entre as 00:00 e as 05:00.
Mário Jorge Santos adiantou que a recuperação (da higiene) da cidade é outro aspecto a ter em conta, pois, segundo o clínico, não se sabe se, quando a paralisação terminar, “se consegue dar destino a todos os resíduos acumulados”.
O presidente da ANMSP acrescentou que a acumulação de lixo biológico e orgânico “nunca é boa para a saúde”, nomeadamente numa época de temperaturas elevadas, que faz com que estes resíduos entrem mais facilmente em decomposição.
Ratos e moscas
Esta conjuntura pode também atrair animais, como ratos e moscas, que acarretam doenças, “embora na atualidade em Portugal essas doenças sejam raras”, frisou Mário Jorge Santos.
O presidente da ANMSP reconheceu, no entanto, que tratando-se de um período curto, “provavelmente não haverá grandes problemas”. De acordo com o profissional de saúde, tudo depende da gestão dos resíduos, que pode ser dificultada pelo processo de transferência de competências para as juntas de freguesia.
Miguel Coelho, presidente da Junta de Freguesia de Santa Maria Maior, que inclui Alfama, o Castelo e a Mouraria, entre outros bairros, apontou que a greve “vai ter consequências muito nefastas para as populações destes bairros, (porque) vão vender muito menos”.
Mário Jorge Santos, presidente da ANMSP, recomendou que os visitantes evitem os locais de grande concentração de lixo e que os moradores tentem produzir o mínimo possível de resíduos.
Na terça-feira, o presidente da Câmara de Lisboa e o Sindicato dos Trabalhadores do Município de Lisboa estiveram reunidos durante cerca de quatro horas e meia, mas sem que a greve tivesse sido desconvocada.
O dispositivo contém dexametasona, um medicamento anti-inflamatório da classe dos corticosteróides que é capaz de combater o edema macular, acumulação de líquido na mácula (parte central da retina, na parte posterior do olho).
O edema macular é uma complicação grave entre diabéticos e pode levar à perda de visão. Normalmente, ocorre entre os pacientes que não têm bom controlo da glicémia. Isto porque as variações de açúcar no sangue inflamam os vasos sanguíneos, que ficam mais permeáveis. Assim, podem ocorrer derrames de líquidos para o exterior dos vasos.
O objectivo da parceria é acelerar a pesquisa sobre o tema. A informação foi divulgada pelo The Wall Street Journal.
O estudo de genes é considerado chave para o entendimento da doença de Alzheimer, cancro e autismo.
A ajuda do Google é considerada importante porque a base de dados sobre o ADN requer uma capacidade de processamento e armazenamento que muitas universidades e hospitais não têm.
O diagnóstico e tratamento tardios, o excesso de peso, a falta de exercício físico, as gravidezes múltiplas e a predisposição genética são algumas das razões que podem explicar a elevada prevalência da doença. Hábitos de vida saudáveis e tratamento atempado são, por isso, essenciais para a prevenção e minimização das consequências desta patologia.
O Grupo Trofa Saúde organiza no próximo sábado (14 de Junho), nas instalações do Hospital Privado de Alfena, a III Conferência “Varizes e hiperhidrose – Tratamentos modernos e inovadores”. Pensada para todos os profissionais de saúde interessados, vão ser apresentadas técnicas inovadoras que têm sido desenvolvidas nos últimos anos, como a radio frequência ou ablação mecânica/química.
“O número de portuguesas que sofre desta patologia tem vindo a aumentar nos últimos anos, e felizmente existe um conjunto de tratamentos que lhes permite recuperar a qualidade de vida e evitar complicações mais sérias. Para impedir que este número continue a crescer, estamos constantemente à procura de tratamentos inovadores”, realça Paulo Pimenta, especialista de Cirurgia Vascular do Grupo Trofa Saúde.
A conferência realiza-se entre as 10:00 e as 12:00 e os interessados deverão inscrever-se, de forma gratuita, através do e-mail [email protected] ou do telefone 229 688 700. Todos os participantes recebem um certificado no final da conferência.
Segundo a Sociedade Portuguesa de Oftalmologia (SPO), a correcção destes erros é feita facilmente através da utilização de óculos, lentes de contacto ou cirurgia refractiva, conforme indicações do médico.
Existem três tipos principais de erros refractivos, explica Paulo Torres, presidente da SPO: “se uma imagem é focada à frente da retina estamos na presença de miopia e há dificuldade em ver imagens focadas à distância. Se a imagem é focada atrás da retina, estamos na presença de hipermetropia; neste caso, um objecto distante é visto com mais nitidez do que um objecto próximo. No entanto, especialmente nos jovens, a hipermetropia pode ser compensada através de um esforço muscular, pelo que as queixas de baixa acuidade visual podem ser poucas. Já no astigmatismo a imagem é focada em dois planos diferentes da retina, pelo que a imagem se torna desfocada, quer para longe quer para perto”.
Outro tipo de erro refractivo, que surge a partir dos 40 anos de idade, é a presbiopia, conhecida como “vista cansada”, que é uma incapacidade de focagem ao perto. “À medida que se envelhece, a lente do olho (cristalino) aumenta de volume e endurece o que, associado à diminuição da ação do músculo ciliar, vai dificultar o processo de acomodação”, afirma Paulo Torres.
O presidente da SPO salienta que os erros refractivos não podem ser prevenidos, mas podem ser diagnosticados e corrigidos. Nas crianças é importante que os erros refractivos sejam corrigidos o mais precocemente possível para não condicionar o completo desenvolvimento da função visual; isto é, para prevenir a ambliopia, o chamado “olho preguiçoso”.
Os erros refractivos podem ser corrigidos através de óculos, lentes de contacto e/ou cirurgia refrativa. “Os óculos são a forma mais simples e segura de correcção de um erro refractivo. As lentes de contacto, sendo colocadas diretamente sobre o olho, funcionam como a primeira superfície refractiva. Estão reservadas para os casos em que o uso de óculos não é possível pela distorção da imagem causada (casos de refracções assimétricas nos dois olhos ou refracções muito elevadas), ou quando, por uma questão profissional (desporto) ou estética, o uso de óculos não se adequa. No entanto, as lentes de contacto não deixam de ser um “corpo estranho”, pelo que podem provocar alterações da superfície ocular, especialmente se o seu uso for desadequado”, defende o especialista.
“As cirurgias com laser ou introdução de lente intraocular são outra das formas de correcção dos erros refractivos, mas podem ser contraindicadas se a estrutura ou a saúde ocular não for a melhor. Cada caso deve ser avaliado pelo oftalmologista assistente”, sublinha Paulo Torres.
Relativamente ao uso de computadores e sua relação com o agravamento dos erros refrativos, Paulo Torres desfaz o mito: “não há dados que comprovem que a utilização do computador contribua para o desenvolvimento de erros refractivos. Mas o uso continuado destes dispositivos pode condicionar muitas vezes um menor pestanejo e o aparecimento de sintomas de olho seco (visão turva, olho vermelho, sensação de ardência e corpo estranho)”.
Páginas
- « primeira
- ‹ anterior
- …
- 1482
- 1483
- 1484
- 1485
- 1486
- 1487
- 1488
- 1489
- 1490
- …
- seguinte ›
- última »