Ciclo de vida dos medicamentos

Quem garante a qualidade, segurança e eficácia dos medicamentos?
O Infarmed é a entidade responsável em Portugal pela regulação dos medicamentos de uso humano em todo o circuito, desde o fabrico de matérias-primas até à sua dispensa e utilização pelos doentes.
Os medicamentos de uso humano estão sujeitos a elevados padrões de qualidade, segurança e eficácia, tendo por base a articulação conjunta de todos os intervenientes no circuito, tais como fabricantes, distribuidores, médicos, farmácias e utilizadores, assim como das autoridades competentes nacionais e comunitários.
Os diferentes intervenientes no circuito do medicamento estão sujeitos a um conjunto de obrigações e procedimentos competindo ao Infarmed acompanhar e garantir a sua aplicação.
Circuito dos medicamentos de uso humano
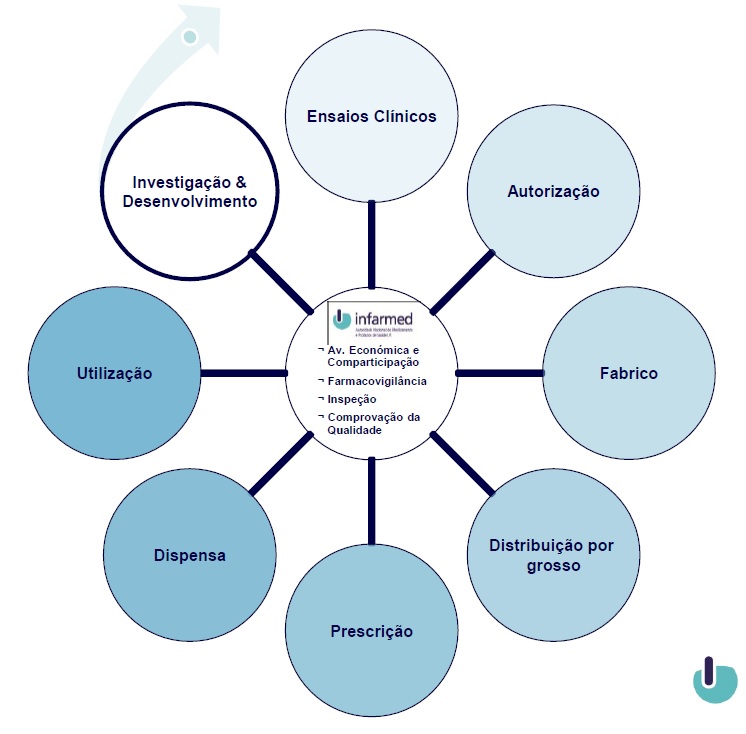
Investigação & Desenvolvimento
Qualquer medicamento começa a ser investigado e desenvolvido cerca de dez anos antes da sua colocação no mercado. Em parceria, a indústria farmacêutica, as faculdades de medicina e de farmácia e outras instituições científicas, nacionais e estrangeiras desenvolvem projectos de investigação, com o objectivo de chegar a uma resposta no combate a determinadas doenças, verificadas na população.
Ensaios clínicos
Antes de ser concedida a Autorização de Introdução do Mercado (AIM) a um medicamento, é ainda necessário testar a eficácia e a segurança da sua utilização no ser humano e para isso realizam-se ensaios clínicos.
Após testes em modelos animais, os medicamentos que obtiverem resultados favoráveis são utilizados experimentalmente em cidadãos voluntários (saudáveis e doentes) para que se obtenha a prova científica de que são seguros e eficazes e como tal podem ser utilizados.
Essa prova científica será analisada para se determinar a relação benefício/risco do futuro medicamento e ajudará também a determinar, com outros factores, se o mesmo pode obter a Autorização de Introdução no Mercado (AIM).
Autorização
Para que um medicamento seja colocado no mercado, é necessário que o Infarmed, ou qualquer agência do medicamento de outro Estado Membro da União Europeia ou a Agência Europeia do Medicamento (EMA) conceda uma Autorização de Introdução no Mercado (AIM).
De modo a garantir a qualidade, a segurança e a eficácia dos medicamentos, a sua aprovação rege-se pelas normas e procedimentos que compõem o Sistema Europeu de Regulação desta área, do qual Portugal faz parte.
Este é um processo rigoroso obedecendo aos mais elevados padrões de qualidade, de modo a garantir a protecção da saúde pública.
À autorização segue-se o seu fabrico ou importação.
Avaliação económica e comparticipação
A avaliação económica tem como objetivo fundamentar a decisão relativamente à comparticipação do Estado no preço dos medicamentos, através da sua avaliação nas vertentes fármaco-terapêutica e económica. Esta avaliação consiste na determinação da mais-valia do medicamento relativamente ao seu valor terapêutico e à sua vantagem económica para o doente.
Fabrico
No âmbito do processo de fabrico, a entidade coordenadora do licenciamento industrial é o Ministério da Economia e do Emprego participando o Infarmed, neste processo, como entidade consultada na área do fabrico de medicamentos e produtos de saúde.
O Infarmed realiza actividades de supervisão e fiscalização, verificando a implementação dos sistemas de boas práticas de acordo com as normas nacionais e procedimentos internacionais estabelecidos pela Comissão Europeia e pela Agência Europeia do Medicamento.
Distribuição
As atividades de abastecimento, posse, armazenagem ou fornecimento de medicamentos destinados à transformação, revenda ou utilização em serviços médicos, unidades de saúde e farmácias, excluindo o fornecimento ao público, depende sempre de autorização do Infarmed.
Prescrição e Dispensa
Os medicamentos são receitados pelo médico, preferencialmente, por via electrónica.
No que respeita à sua venda, os medicamentos podem classificar-se, como:
¬ Sujeitos a receita médica;
¬ Medicamentos de receita médica especial (ex. estupefacientes e psicotrópicos);
¬ Medicamentos de receita médica restrita (uso exclusivo hospitalar ou em alguns casos ambulatório, mas sujeito a uma vigilância especial por parte do especialista durante o período de tratamento);
¬ Não sujeitos a receita médica.
Utilização
Os doentes têm o dever de procurar informação e o direito a ser informados quanto às suas próprias responsabilidades para um uso correto e adequado dos medicamentos. Os profissionais de saúde, médicos e farmacêuticos, que têm um papel fundamental na promoção da utilização racional dos medicamentos, deverão prestar todos os esclarecimentos aos doentes, sempre que necessário.
Farmacovigilância
Sempre que o doente suspeitar de uma reacção adversa provocada pela utilização de um medicamento, deve de imediato informar o profissional de saúde que o assiste.
Os profissionais de saúde (médicos, farmacêuticos e enfermeiros) comunicam ao Infarmed, tão rápido quanto possível, as reacções adversas e suspeitas de reacções adversas graves ou inesperadas de que tenham conhecimento resultantes da utilização de medicamentos.
O Infarmed analisa e avalia estas reacções e consoante a sua gravidade e repercussão, pode tomar medidas que podem passar pela emissão de alertas, pela suspensão parcial ou retirada do mercado de determinado medicamento.
Inspecção
As acções de inspecção, da responsabilidade do Infarmed, visam averiguar, identificar e monitorizar defeitos de qualidade relativos à produção industrial de medicamentos e à actividade de licenciamento de entidades, nomeadamente, armazenistas, farmácias e locais de venda de medicamentos não sujeitos a receita médica.
Estas acções incidem sobre a:
¬ Produção de medicamentos;
¬ Avaliação do cumprimento das boas práticas de fabrico;
¬ Monitorização dos medicamentos comercializados.
Caso se detectem não conformidades o Infarmed solicita a sua correcção num determinado prazo.
Se as mesmas forem consideradas críticas e previstas na legislação poderá haver lugar à instrução de processo de contraordenação social.
Comprovação da qualidade
O Infarmed, através do seu laboratório, tem também como missão verificar a qualidade dos medicamentos, bem como das matérias-primas e dos produtos de saúde (dispositivos médicos, cosméticos, etc.) que se comercializam em Portugal.
Os lotes de medicamentos que não cumprem as especificações são alvo de medidas adequadas a cada caso específico, destinadas a garantir que os medicamentos que os doentes têm à sua disposição, têm qualidade, são seguros e eficazes.
Contactos e Informações adicionais
Através deste conjunto de actividades, o Infarmed e as restantes entidades envolvidas, garantem a qualidade, a segurança e a eficácia de todos os medicamentos à disposição dos doentes em Portugal.
Para informações mais detalhadas sobre o ciclo de vida do medicamento, consulte as áreas técnicas do site do Infarmed ou marque a Linha do Medicamento, 800 222 444, para esclarecimentos adicionais.
