Dispositivos médicos
Quem garante a qualidade, segurança e desempenho dos dispositivos médicos?
Os diferentes intervenientes, tais como fabricantes, distribuidores, importadores, profissionais de saúde, organismos notificados (avaliadores de dispositivos médicos) e os utilizadores estão sujeitos a um conjunto de obrigações e procedimentos, competindo ao Infarmed acompanhar e garantir a sua aplicação em prol da protecção da saúde pública.
Exemplos de dispositivos médicos:
Ligaduras, fraldas e pensos para incontinência, algodão, meias de compressão, pensos para protecção e/ou tratamento de feridas, cadeiras de rodas, macas e camas hospitalares, estetoscópio, instrumentos cirúrgicos, termómetros, seringas e agulhas, compressas, lentes de contacto, equipamentos de ressonância magnética e de tomografia, incubadoras, preservativos, válvulas cardíacas, próteses dentárias e ortopédicas, óculos de correcção, luvas de exame, pacemakers.
Circuito dos dispositivos médicos
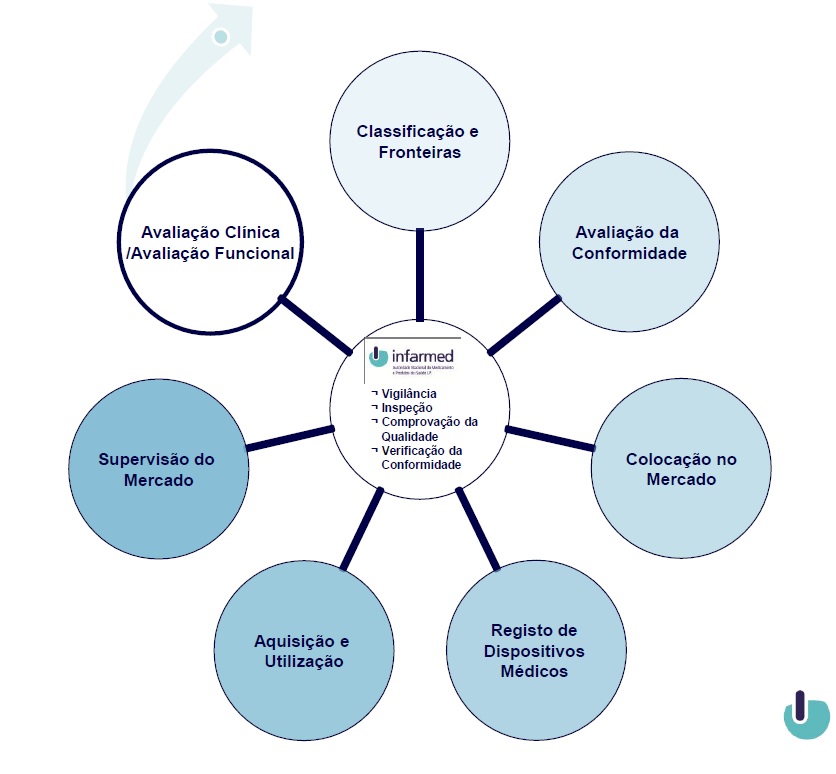
Avaliação clínica
A demonstração da conformidade de um dispositivo médico com os requisitos essenciais (exigências mínimas de qualidade, segurança e desempenho estabelecidas na lei) deve incluir uma avaliação baseada em dados clínicos.
O que são dados clínicos?
Informação relativa à segurança ou ao desempenho, obtida a partir da utilização de um dispositivo médico em seres humanos.
Esta informação poderá ser proveniente de investigação clínica, ou outros estudos constantes da literatura científica respeitante ao próprio dispositivo ou a um dispositivo similar, cuja equivalência está demonstrada.
Classificação
Os dispositivos são integrados nas classes I (baixo risco), IIa (médio risco), IIb (médio risco) e III (alto risco), tendo em conta a vulnerabilidade do corpo humano e atendendo aos potenciais riscos decorrentes da concepção técnica e do fabrico.
Esta classificação é atribuída pelo fabricante tendo em conta as regras de classificação estabelecidas na legislação.
Fronteiras legislativas
Alguns produtos, pela sua finalidade e pelo mecanismo de acção pelo qual é alcançado o principal efeito pretendido no corpo humano, podem ser qualificados como dispositivos médicos ou ter outras qualificações:
¬ Óculos de correção (dispositivo médico) Vs. Óculos de sol (equipamento de protecção individual);
¬ Luvas de exames médicos (dispositivo médico) Vs. Luvas usadas para colheita de amostras do corpo humano (equipamento de protecção individual);
¬ Desinfectante de instrumentos cirúrgicos (dispositivo médico) Vs. Desinfectante de superfícies (biocida).
Avaliação da conformidade
Um dispositivo deve ser apropriado à sua finalidade.
¬ Quando um fabricante produz determinado dispositivo tem que o fazer cumprindo os requisitos legais, que vão desde os materiais usados, à forma como são fabricados e rotulados.
¬ Um dispositivo médico tem que ser avaliado e se tudo estiver em conformidade, é-lhe atribuída a marcação CE e só com ela é que o produto pode ser disponibilizado no mercado europeu.
Registo de dispositivos médicos
Os fabricantes, seus representantes autorizados na União Europeia, e os distribuidores por grosso de dispositivos médicos, como responsáveis pela colocação no mercado de dispositivos médicos, deverão dar cumprimento ao registo dos produtos que comercializam, junto do Infarmed através de um sistema on-line.
Este registo é essencial para o conhecimento dos dispositivos colocados no mercado e dos agentes económicos envolvidos na sua cadeia de distribuição garantindo assim a sua rastreabilidade no mercado, sobretudo na resposta rápida à ocorrência de incidentes.
Aquisição e utilização de dispositivos médicos
Os utilizadores de dispositivos médicos devem preocupar-se em adquirir e utilizar dispositivos que apresentem aposta a marcação CE como prova da sua conformidade com os requisitos essenciais. Poderão, sempre que necessário solicitar junto do fabricante ou do distribuidor do dispositivo documentos que atestem essa conformidade. Deverão, também, verificar se a rotulagem e o folheto informativo se encontra redigido em língua portuguesa e se o dispositivo, a sua finalidade e o seu fabricante estão devidamente identificados na rotulagem.
O utilizador deverá utilizar o dispositivo para o fim previsto pelo fabricante e de acordo com as instruções de utilização, manutenção e/ou calibração.
O utilizador tem um papel essencial na supervisão do mercado informando a autoridade, Infarmed, dos problemas que verifiquem nos dispositivos médicos, de forma a serem adoptadas medidas que evitem a sua repetição. Neste caso, contacte Direção de Produtos de Saúde, Telefone: 21 798 7145 ou e-mail: [email protected].
Supervisão do mercado
O Infarmed, enquanto autoridade competente para os dispositivos médicos, tem como uma das suas principais missões a fiscalização do mercado assegurando que, independentemente da origem dos dispositivos, estes ofereçam iguais níveis de qualidade, segurança e desempenho, garantindo a protecção da saúde pública.
Neste contexto, são realizadas algumas acções de supervisão do mercado direcionadas a determinados grupos de dispositivos médicos, seleccionados com base em processos de amostragem, tendo em conta critérios identificados como relevantes para a protecção da saúde pública, contemplando assim, produtos de fabricantes nacionais e distribuidores por grosso que actuam no mercado nacional.
As actividades de fiscalização baseiam-se em análise documental e/ou laboratorial e/ou inspectiva.
Colocação no mercado
Só poderão ser colocados no mercado os dispositivos médicos que respeitem os requisitos previstos na legislação, quando correctamente disponibilizados, mantidos e utilizados de acordo com a finalidade prevista.
Desta forma o fabricante, antes de colocar o dispositivo médico no mercado europeu, deverá sujeitá-lo a um processo de avaliação da conformidade com tais requisitos, conforme procedimento previsto na legislação aplicável, com vista à aposição da marcação CE. Deve também elaborar a declaração CE de conformidade e notificar a autoridade competente.
À autoridade competente, no caso de Portugal, o Infarmed, cabe tomar todas as medidas necessárias para garantir que os dispositivos médicos existentes no seu mercado respeitam os requisitos de qualidade, segurança e desempenho funcional assegurando assim a protecção da saúde pública.
Onde posso obter mais informação sobre dispositivos médicos?
Para informações mais detalhadas e esclarecimentos adicionais sobre o ciclo de vida dos dispositivos médicos, consulte as áreas técnicas do site do Infarmed ou marque a Linha do Medicamento 800 222 444, que também esclarece sobre produtos de saúde (dispositivos médicos e produtos cosméticos).
